癌症是导致人类死亡的首要原因之一,已成为公共健康的主要挑战。近年来,高灵敏度的检测技术促使新的肿瘤特异性分子生物标志物不断涌现,显著的改善了癌症的临床诊疗。分子病理评估如今已变得格外重要,因为它不仅可以指导肿瘤诊断和预后,还可以辅助临床制定更有效的治疗方案。尽管肿瘤组织病理仍是癌症诊断和分型的金标准,很多研究已表明液体活检可作为检测肿瘤特异性生物标志物的潜在工具1-4。
相比于肿瘤组织检测,液体活检的一个主要优势在于血液中微量的循环肿瘤DNA(ctDNA)可提供肿瘤异质性信息,并反映肿瘤负荷的动态变化。因此,液体活检作为一种无创的分子检测手段已逐步成为监测癌症的准确而可靠的替代方法。然而由于对极低丰度的基因组异常的可靠检出存在较大的挑战,液体活检技术仍需要不断完善以适用于日常临床检测需求。数字PCR作为一种高灵敏度和高特异性的分子检测方法可解决这一技术难题。
数字PCR检测ctDNA的优势与局限性数字PCR的主要优势在于它的高灵敏度,通过将样本分割为上万个单元而实现对极低丰度突变(MAF: 0.01%)和微小拷贝数变化的检测,这是其他检测方法所无法达到的。qPCR一般可稳定检出MAF>1%的突变,其他基于PCR的方法(如COLD-PCR、PNA-LNA PCR Clamp)可检出MAF低至0.1%的突变5,6。靶向富集技术的发展,使高深度NGS(如TAm-Seq、Safe-Seq和CAPP-Seq)可检出MAF低至0.02%的突变7-9,接近数字PCR的灵敏度,但该技术需要更高的DNA进入量,且其标准化程度也远低于数字PCR。
数字PCR的另一个优势在于它的绝对定量,对于液体活检而言,其他定性或相对定量的方法在检测低丰度变异时更容易由于低进入量的DNA而产生假阴性。数字PCR的绝对定量不需要依靠参考曲线校准,因此可以避免由参考曲线引入的误差。数字PCR有很高的可重复性,因为它的性能指标和错误率可通过数学公式轻易的计算得出,使得整个工作流程的优化显著提高。因此,数字PCR凭借其高度的可靠性常用于验证其他检测技术(如NGS)。
此外,数字PCR由于其分割反应单元体积微小,其中的血红蛋白、肝素等相比于qPCR也显著降低,因此数字PCR不容易受到PCR抑制物的影响。相比于NGS,数字PCR的操作流程简单、检测快捷、成本更低,且无需复杂的生信分析,不会产生大量的意义未明的变异信息,干扰临床决策。
当然数字PCR也有局限性,主要表现在多重检测能力方面,其能同时检测的目标数量显著低于NGS。因此在癌症诊疗的初始,通常先进行NGS检测以确定肿瘤特定的变异,再通过数字PCR在癌症治疗全程监测跟踪这些变异的进展。近年来,多重数字PCR技术的发展也使得该局限性得到了显著改善10-13。普济生物自主研发的新型超多重PCR技术联合6色荧光通道的数字PCR可以均一的扩增效率实现同时对数百重变异的高灵敏度检测,其对实体瘤患者外周血ctDNA的突变检测结果与NGS高度一致。
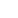
基于数字PCR的液体活检在癌症诊疗全周期中的应用尽管肿瘤组织病理仍是当前癌症诊断和分型的主要依据,它也存在很多局限性:1)肿瘤组织需要通过有创的手段获取,会对患者造成潜在的危害,另外某些肿瘤由于在体内的位置或已扩散转移而无法获取;2)获取的小部分肿瘤组织无法全面的反映肿瘤整体的异质性14。液体活检作为一种无创的分子检测技术可以克服肿瘤组织检测的不足,更准确的监控肿瘤状态。液体活检的样本主要来源于血液,但也可来源于其他体液,如唾液、脑脊液、粪便、尿液等。血液中可分离出多种肿瘤生物标志物,如循环肿瘤细胞(CTCs)、外泌体(EVs)、循环游离DNA(cfDNA)、微小RNA(miRNA)等15,分子检测技术的进步和标准化使得cfDNA检测得到了迅速发展。cfDNA主要由大量正常细胞分泌的DNA和少量肿瘤细胞来源的DNA(ctDNA)组成,因此需要使用极高灵敏度的分子检测技术才能准确分析微量ctDNA中的基因组变异16。数字PCR以其高灵敏度和高特异性等优势,已在液体活检上体现出巨大的价值,参与癌症诊疗管理的全周期(图1),包括癌症诊断、预后、个体化治疗和疾病进展监控17。
.png)
图1. 微滴式数字PCR检测cfDNA的原理和在癌症诊疗中的应用17
肿瘤精准治疗时代的来临促使多种基于数字PCR,通过液体活检,检测靶向药物基因突变技术的开发和商业化。2003年美国FDA批准表皮生长因子受体络氨酸激酶抑制剂(EGFR-TKIs)治疗EGFR突变阳性的肺腺癌患者,随后基于PCR技术的分子诊断试剂盒相继获批,如TheraScreen® EGFR RGQ PCR Kit(Qiagen)和 Cobas® EGFR Mutation Test v2(Roche),最近基于NGS技术的分子诊断试剂盒也已获批上市,如Guardant360(Guardant Health)和FoundationOne CDx(Foundation Medicine)。通过这些分子检测技术对EGFR-TKI耐药的肺腺癌患者的肿瘤分析发现多种耐药突变,如60%的耐药患者产生了EGFR T790M突变18。这一发现促使靶向EGFR T790M突变的第三代EGFR-TKIs及其伴随诊断试剂盒Cobas® EGFR Mutation Test v2的获批上市。TKI耐药突变需要准确特异的检测技术实时监控肿瘤分子图谱的动态变化,因此无创的液体活检比重新获取肿瘤组织进行检测更具优势。相比于Cobas®等PCR技术,数字PCR具有更高的灵敏度和特异性,在血浆cfDNA中可检出更高比例的EGFR突变19-21,这些研究推动了临床采用基于数字PCR的液体活检监控EGFR突变阳性肺癌患者的靶向治疗效果。
2008年研究发现RAS突变是导致结直肠癌抗EGFR治疗产生耐药的主要机制22。随后基于数字PCR的OncoBEAMTM CRC RAS kit于2016年获得CE-IVD认证,并已广泛应用于临床液体活检,其在血液cfDNA中的检测结果与临床金标准肿瘤组织检测结果的一致性高达90%23-25。多项研究对比数字PCR和NGS检测血浆KRAS突变的性能,两种方法的血检结果与肿瘤组织检测结果均具有很高的一致性,但数字PCR有更高的灵敏度,在更低的DNA进入量下可实现更低的检测下限26,27。此外,数字PCR检测血浆中的RAS突变丰度对肿瘤的早期筛查、预后、疗效预测和术后微小残留病灶(MRD)监测等方面均可提供重要的信息16,28,29。
2019年美国FDA批准阿培利司靶向治疗PIK3CA突变阳性的乳腺癌患者,其伴随诊断试剂盒TheraScreen® PIK3CA RGQ PCR Kit(Qiagen)也同时获批用于肿瘤组织PIK3CA突变检测。通过数字PCR分析乳腺癌患者血液cfDNA中的PIK3CA突变显示其与肿瘤组织的一致性可达83%,且与靶向治疗效果呈正相关30。PIK3CA突变也可作为乳腺癌预后的生物标志物,数字PCR检测血液中的PIK3CA突变状态显示高ctDNA水平是早期乳腺癌患者预后差的独立风险因素31。此外,数字PCR在分析芳香脢抑制剂治疗乳腺癌产生的ESR1耐药突变上也发挥着重要作用,其在血液cfDNA中检测ESR1突变与肿瘤组织结果的一致性可达74%32。因此,数字PCR可用于乳腺癌患者血液PIK3CA和ESR1的突变检测,体现其在MRD监测和耐药复发风险预测中的价值。
数字PCR还可以检测除点突变或微小插入缺失以外的其他基因组变异,如拷贝数变异(CNVs)和基因的甲基化状态。对比原位杂交、基因组杂交或NGS,数字PCR检测CNVs更简单快捷。而相比于传统的qPCR方法,数字PCR在检测微小CNVs并绝对定量拷贝数方面更可靠33。在CNV检测的临床应用上,数字PCR可高效的检出乳腺癌和胃癌患者肿瘤组织和血浆中的HER2扩增34,35、去势抵抗性前列腺癌患者血浆中的AR突变和CNVs36,以及多种癌症患者治疗前和疾病进展时血浆中的MET扩增(EGFR-TKIs耐药机制之一)37。在甲基化检测的临床应用上,数字PCR可准确的检测血浆cfDNA中多种基因(如HOXA9、SEPT9、HOXD8、POU4F1等)的甲基化水平,为上皮性卵巢癌、结直肠癌或转移性胰腺癌的预后或疗效提供重要信息38-40。
综上所述,数字PCR通过“分而治之”的原理将PCR反应分隔至大量的微小单元中以实现对血液中极微量的肿瘤变异的高灵敏检测,在癌症治疗靶点发现、实时监控疗效、耐药机制发现、肿瘤早检和MRD评估等临床应用中起到了日益重要的作用。然而距离实现基于数字PCR的液体活检在日常临床上的全面应用目标,我们仍有一定的差距,这与当前数字PCR技术的局限性不无关系:1)数字PCR检测的设计需要精准的验证和专业的技能;2)检测目标需要提前明确;3)数字PCR的多重检测能力仍然有限;4)标准化流程仍存在一些障碍。相比于NGS,数字PCR在未来的临床应用也存在不小的挑战:数字PCR专注于分析小量的生物标志物,可能更适合于以患者为中心的个性化检测设计,而NGS检测可提供更广泛的基因组变异信息。因此,NGS可能会更多的应用于基于液体活检的肿瘤诊断和靶向治疗耐药机制分析,而数字PCR仍将是MRD监控和在检测下限时验证NGS结果的有力工具。两种技术各有自身的优势,可在不同的临床应用场景相互补充,而不是相互竞争。
上一篇:基于数字PCR的液体活检在肺癌个体化治疗中的临床应用进展
下一篇:没有了....