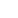
国家癌症中心发布的2022年全国癌症统计数据显示,我国肺癌发病率居恶性肿瘤首位,新发肺癌病例约为82.8万例,病死率也居恶性肿瘤之首,5年生存率仅为19.7%。约80%的肺癌病例为非小细胞肺癌(NSCLC),且大多数患者在诊断时已属于晚期。近10年来的科学研究在NSCLC的亚型肺腺癌中发现了一系列的致癌驱动基因变异,如KRAS(32.2%)、EGFR(11.3%)、BRAF(7%)、MET的14号外显子跳读(4.2%)、PIK3CA(2%)、HER2(2%)、ALK融合(3.9%)、ROS1融合(2%)、RET融合(1%)、NTRK融合(0.2%)、MET扩增(2.2%)和HER2扩增(0.9%)等1。而肺鳞癌中的致癌驱动基因变异有PIK3CA(12%)、PTEN(10%)和FGFR1扩增(20%)等(图1)2。这些肿瘤细胞DNA分子标志物的发现使得肺癌的临床治疗从统一标准化的治疗如化疗逐步向更精准的个体化治疗方案转变,因此对这些驱动基因变异的筛查已成为制定肺癌个体化治疗方案的刚需。肿瘤组织的分子检测是临床对肺癌诊断和分型的金标准,但由于肿瘤组织的可及性和异质性等局限,液体活检作为互补的无创均一性分子检测技术在肺癌的个体化治疗中得到了迅速的发展。检测血液中的微量ctDNA作为液体活检的主要形式可通过PCR(如ARMS-PCR、数字PCR)或高深度NGS(如CAPP-seq、TAm-seq)方法实现,两种技术各有自身的优势,可在不同的临床应用场景相互补充。本文将着重介绍数字PCR检测血液ctDNA驱动基因在肺癌个体化治疗全程的重要作用。
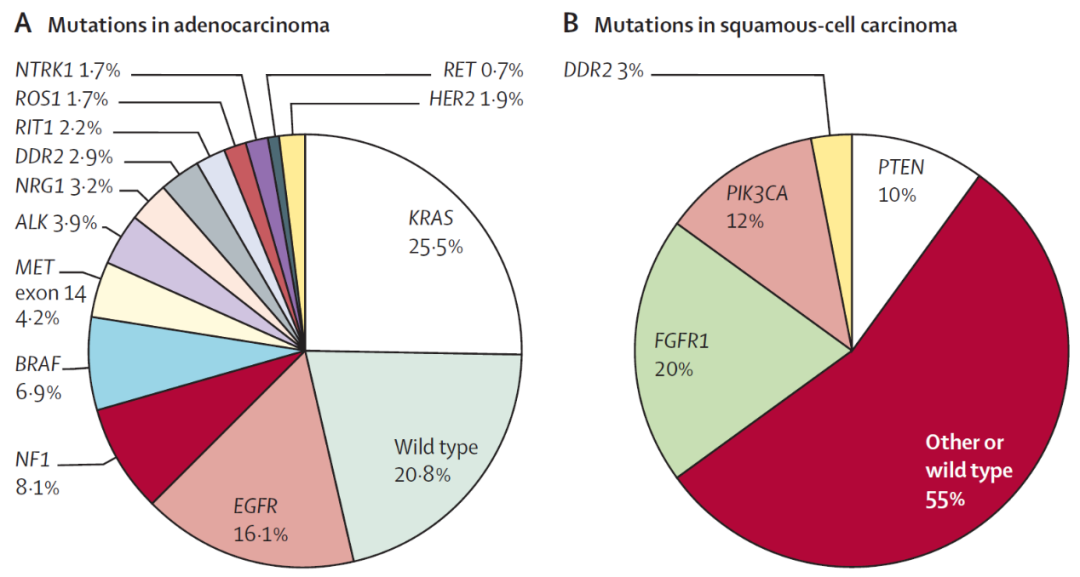
图1. 肺癌的基因组变异图谱(A.肺腺癌 B.肺鳞癌)2
明确疾病靶标,指导一线治疗
EGFR突变阳性是NSCLC的一个重要分子亚型,其中21号外显子突变L858R、L861Q和19号外显子缺失占所有EGFR突变的85%,此类突变可导致EGFR络氨酸激酶异常激活和细胞增殖失控,该类激活突变阳性的NSCLC患者对EGFR络氨酸激酶抑制剂(TKIs)敏感,因此NCCN指南推荐晚期或转移性NSCLC进行EGFR突变检测以识别可能从EGFR-TKIs一线治疗中获益的患者(图2)。
高灵敏度多重数字PCR可在血液中检测到丰度低至0.04%的EGFR突变3-5,有利于指导此类NSCLC患者的一线治疗。丝氨酸/苏氨酸激酶BRAF是MAP/ERK信号通路的一部分,该基因的V600E突变可导致信号通路异常激活,拥有该突变的晚期或转移性NSCLC患者可从BRAF/MEK抑制剂联合的一线或后续治疗中获益,数字PCR可在福尔马林固定的石蜡组织切片(FFPE)中准确的检测到丰度低至0.05%的V600E突变6。络氨酸受体激酶ALK、ROS1、RET和NTRK1/2/3可在NSCLC中发生重排,导致癌细胞信号通路的异常激活和细胞增殖,该类融合突变阳性的NSCLC患者对相应的TKIs敏感,可用于一线或后续治疗。临床上检测融合基因变异的金标准荧光原位杂交(FISH)或免疫组化(IHC)的检测下限仅有15%,因此近年来NGS也被用于检测多种常见于NSCLC中的融合变异,其检测下限可达1-2%。数字PCR作为一种更灵敏的检测手段,可在FFPE中检测到丰度低至0.25%的最为常见的ALK-EML4融合变异7。络氨酸受体激酶MET在NSCLC中可发生导致外显子14缺失的跳跃突变,引起PI3K和RAS/RAF通路信号转导失调,该突变阳性的晚期或转移性NSCLC患者可使用MET-TKIs进行一线或后续治疗。
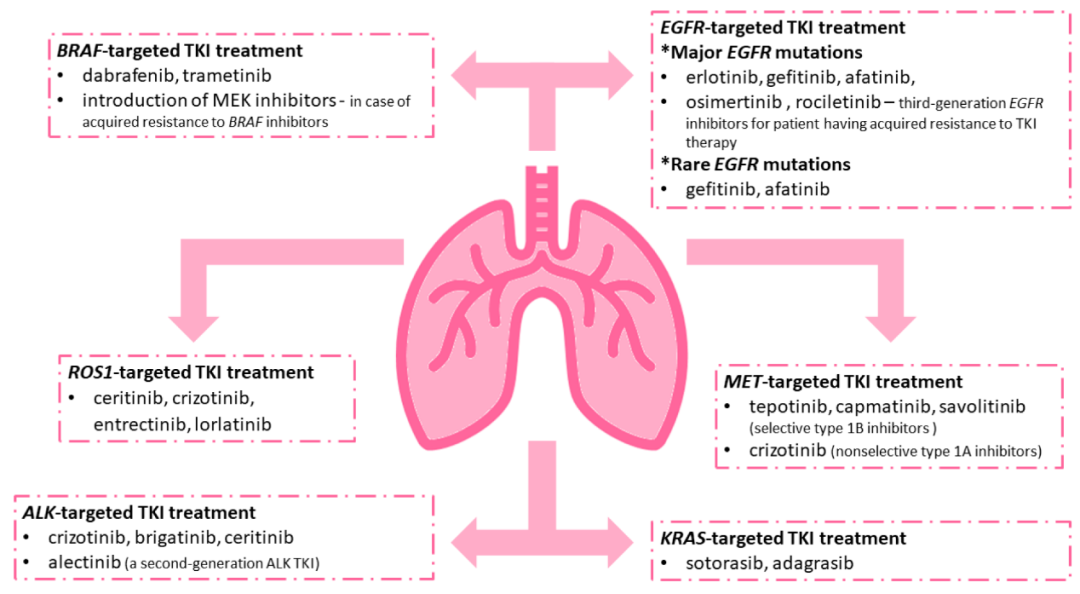
图2. NSCLC患者检测驱动基因变异指导TKI靶向治疗8
探索耐药机制,更换治疗方案
尽管一代/二代EGFR-TKIs可有效治疗特定的EGFR激活突变型NSCLC患者,将无进展生存期(PFS)延长了将近一倍,但大部分患者在使用该类药物一线治疗8-14个月后仍会产生耐药导致疾病进展或复发,研究发现约60%的耐药患者新发了EGFR T790M突变(图3),该突变可增强EGFR络氨酸激酶与ATP的结合能力而使EGFR-TKIs的抑制效能降低,这一发现促使了可特异性抑制该突变的第三代EGFR-TKI(奥西替尼)的研发和获批。尽管奥西替尼对拥有T790M突变的NSCLC患者通常有效,但仍有部分会产生新的耐药突变,其中约20%的三代TKI耐药是由EGFR C797S顺式突变引起的,该突变可阻断第三代EGFR-TKI与C797的共价结合,使药物失效。
经奥西替尼治疗T790M突变清零但仍具有EGFR敏感性突变和C797S突变的NSCLC患者转用一代/二代EGFR-TKIs治疗有效。数字PCR可对血浆中的EGFR敏感性突变(如L858R、L861Q和19号外显子缺失等)和耐药性突变(如T790M、C797S)进行实时动态监测9,相比于Cobas®等PCR技术有更高的灵敏度,可检出更高比例的EGFR突变,有利于尽早发现耐药机制,更改治疗策略延缓或避免耐药肿瘤细胞克隆的增生。约20-30%的ALK重排阳性的患者经一代ALK-TKI(克唑替尼)治疗后会产生ALK激酶区域内的耐药性突变(如G1202R、F1174C/L、L1196M、G1269A、C1156Y、1151Tins、L1152R、S1206Y、I1171T、D1203N、V1180L),这些耐药患者可使用二代ALK-TKIs治疗,但仍有部分拥有G1202R突变的患者使用二代ALK-TKIs治疗无效,此类患者可使用三代ALK-TKI(劳拉替尼)治疗。和其他TKI类似,劳拉替尼也会诱导新的耐药突变如L1198F,该突变会降低三代ALK-TKI的结合效能,但可增强一代ALK-TKI的结合能力,而使其重新对克唑替尼敏感。类似的,艾乐替尼对由色瑞替尼诱导的G1123S耐药突变有效,而色瑞替尼可治疗艾乐替尼诱导的I1171T耐药突变。多重数字PCR可对ALK重排阳性的患者进行靶向治疗全程动态监控,及时发现特定的耐药突变以有效指导后续治疗10。约40%克唑替尼治疗的ROS1融合突变阳性的患者会产生ROS1 G2032R、L2026M、S1986F和K1991E耐药突变,此类耐药患者(除G2032R外)换用劳拉替尼有效。KRAS是另一个突变频发于NSCLC的重要致癌驱动基因,其12号和13号氨基酸变异是导致多种肿瘤发生和进展的主要原因。KRAS突变可通过激活MAPK/ERK信号通路降低NSCLC患者对EGFR-TKIs的敏感性,多年的药物研发终于突破了KRAS不可成药靶点的困境,2021年唯一一款针对KRAS G12C突变的抑制剂(Sotorasib)获得FDA批准上市用于该突变阳性的晚期或转移性NSCLC患者的后续治疗。
多重数字PCR可快速准确的在血液中检测到丰度低于0.2%的高频G12和G13 KRAS突变11-14。此外,致癌驱动基因的扩增也可导致TKI耐药,MET可与ERBB3形成二聚体而不依赖于EGFR独立激活PI3K/AKT信号通路,高水平MET扩增常见于5-10%一代EGFR-TKI耐药和多至30%奥西替尼耐药患者中,此类NSCLC患者使用MET-TKIs治疗可显著改善疗效,控制疾病进展。络氨酸激酶受体HER2属于EGFR家族,可独立激活PI3K/AKT信号通路,HER2扩增可发生于多至13%的EGFR-TKI耐药患者中,新一代HER2抗体偶联药物(德喜曲妥珠单抗)对HER2扩增的NSCLC耐药患者有效。多重数字PCR可对EGFR突变阴性的NSCLC患者检测MET和HER2扩增,指导EGFR-TKI耐药后的靶向治疗15。
图3. EGFR-TKI的耐药机制和发生频率16
监控疾病进展,预测治疗效果
对接受TKI靶向治疗的NSCLC患者血浆中驱动基因变异丰度的动态变化进行高灵敏度的数字PCR定量监控在预测TKI疗效方面也起着重要作用。研究发现治疗前基线血浆中EGFR突变丰度高的患者使用EGFR-TKI治疗的预后较差17,经EGFR-TKI治疗3轮后,血浆中EGFR突变仍为阳性的患者其PFS和总生存期(OS)显著降低,而治疗3周或6周后血浆中EGFR突变清零的患者预后较好18-20。类似的,ALK重排阳性的NSCLC患者经三代ALK-TKI(劳拉替尼)首次治疗4周后血浆中ALK重排或突变丰度降低与较好的预后和PFS延长相关21,早期血浆中BRAF突变丰度的动态变化可有效预测BRAF抑制剂的疗效22。尽管基于ctDNA的无创性液体活检在预测疗效和发现耐药机制中已体现了其独特的临床价值,该方法相比于组织活检也存在由以下原因导致的假阴性的局限和挑战:
1)脱落细胞产生的cfDNA浓度在不同肿瘤亚型和患者间存在显著的个体化差异;
2)血浆中cfDNA检测的灵敏度依赖于肿瘤的位置和大小;
3)在无进展或疗效较好的患者中cfDNA的水平通常较低。不同的cfDNA检测方法和平台也会造成技术上的假阴性,此类技术假阴性在检测下限低至0.01-1%的高灵敏度数字PCR或NGS检测中很难出现,但可常见于灵敏度较差的检测方法,如ARMS-PCR或PNA-LNA PCR。普济生物自主研发的新型超多重PCR技术联合6色荧光通道的数字PCR,仅需要10 ml全血和2管PCR反应即可实现对EGFR/KRAS/BRAF热点突变、ALK/ROS1/RET/NTRK常见融合变异和MET 14号外显子跳跃突变的高灵敏度检测,全面覆盖NCCN指南推荐的NSCLC靶向治疗相关8个关键驱动基因、48种常见热点突和28种跳跃/融合变异,其对NSCLC患者外周血ctDNA的突变检测结果与NGS检测的一致率高达93%。该技术相比高深度NGS拥有更短的检测周期和更低的检测成本,无需繁杂的生信分析,有利于日常临床标准化检测的推广和普及,在精准指导NSCLC患者一线靶向治疗、耐药探索、动态监控、预测疗效和制定疾病进展后的后续治疗方案等方面均有巨大的应用前景和临床价值。